Metodo de la lluvia
Este te permite saber que numero cuántico y que orbital es el que viene, y así poder llenar los orbitales con electrones. Es el método usado en química para describir la configuración electrónica de los elementos tomando en cuenta su número atómico. Se usa para ubicar al elemento en la tabla periódica sacando su grupo y periodo.
1s2
2s2 p6
3s2 p6 d10
4s2 p6 d10 f14
5s2 p6 d10 f14
6s2 p6 d10 f14
Entre los conocimientos actuales o no sobre el átomo, que han mantenido su veracidad, se consideran los siguientes:
1. La presencia de un núcleo atómico con las partículas conocidas, la casi totalidad de la masa atómica en un volumen muy pequeño.
2. Los estados estacionarios o niveles de energía fundamentales en los cuales se distribuyen los electrones de acuerdo a su contenido energético.
3. La dualidad de la materia (carácter onda-partícula), aunque no tenga consecuencias prácticas al tratarse de objetos de gran masa. En el caso de partículas pequeñas (electrones) la longitud de onda tiene un valor comparable con las dimensiones del átomo.
4. La probabilidad en un lugar de certeza, en cuanto a la posición, energía y movimiento de un electrón, debido a la imprecisión de los estudios por el uso de la luz de baja frecuencia.
La configuración electrónica del átomo de un elemento corresponde a la ubicación de los electrones en los orbitales de los diferentes niveles de energía. Aunque el modelo de Scrödinger es exacto sólo para el átomo de hidrógeno, para otros átomos es aplicable el mismo modelo mediante aproximaciones muy buenas.
La manera de mostrar cómo se distribuyen los electrones en un átomo, es a través de la configuración electrónica. El orden en el que se van llenando los niveles de energía es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p. El esquema de llenado de los orbitales atómicos, lo podemos tener utilizando la regla de la diagonal, para ello debes seguir atentamente la flecha del esquema comenzando en 1s; siguiendo la flecha podrás ir completando los orbitales con los electrones en forma correcta.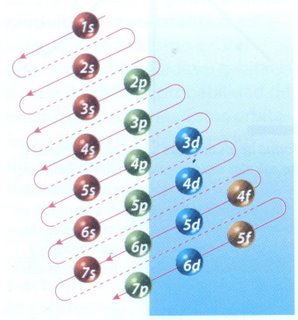
Por el método de la lluvia se llena en el siguiente orden (1s 2s 2p 3s 3p 4s 3d 4p 5s... es cono si pasaras una flecha diagonal leyendo de derecha a izquierda.


Método
Atómico Actual
Entre los conocimientos actuales o no sobre el átomo, que han mantenido su veracidad, se consideran los siguientes:
1. La presencia de un núcleo atómico con las partículas conocidas, la casi totalidad de la masa atómica en un volumen muy pequeño.
2. Los estados estacionarios o niveles de energía fundamentales en los cuales se distribuyen los electrones de acuerdo a su contenido energético.
3. La dualidad de la materia (carácter onda-partícula), aunque no tenga consecuencias prácticas al tratarse de objetos de gran masa. En el caso de partículas pequeñas (electrones) la longitud de onda tiene un valor comparable con las dimensiones del átomo.
4. La probabilidad en un lugar de certeza, en cuanto a la posición, energía y movimiento de un electrón, debido a la imprecisión de los estudios por el uso de la luz de baja frecuencia.
Fue
Erwin Schrödinger, quien ideó el modelo atómico actual, llamado "Ecuación
de Onda", una fórmula matemática que considera los aspectos anteriores. La
solución de esta ecuación, es la función de onda (PSI), y es una medida de la
probabilidad de encontrar al electrón en el espacio. En este modelo, el área
donde hay mayor probabilidad de encontrar al electrón se denomina orbital.
El
valor de la función de onda asociada con una partícula en movimiento esta relacionada
con la probabilidad de encontrar a la partícula en el punto (x,y,z) en el
instante de tiempo t.
En
general una onda puede tomar valores positivos y negativos. una onda puede
representarse por medio de una cantidad compleja.
Por
ejemplo en el campo eléctrico de una onda electromagnética. Una probabilidad
negativa, o compleja, es algo sin sentido.
Esto
significa que la función de onda no es algo observable. Sin embargo el módulo
(o cuadrado) de la función de onda siempre es real y positivo. Por esto, se le
conoce como la densidad de probabilidad.
La
función de onda depende de los valores de tres (03) variables que reciben la
denominación de números cuánticos. Cada conjunto de números cuánticos, definen
una función específica para un electrón.
Interacción entre Protones y Neutrones
Las
interacciones de las partículas elementales permiten mantener la estabilidad
del núcleo. Según el modelo atómico de Rutherford, los electrones giran
alrededor del núcleo, lo cual hace que genere una fuerza centrípeta que tiene
la tendencia de alejar a los electrones; sin embargo, estos no escapan debido a
la atracción que ejerce la carga positiva de los protones en el núcleo. Esta
interacción electron-proton puede explicar la estabilidad del átomo
No
obstante, los científicos de la época de Rutherford conocían que cualquier
partícula con carga eléctrica en movimiento pierde energía al girar, por lo que
los electrones en movimiento según el modelo atómico nuclear finalmente
perderían energía y se precipitaran sobre el núcleo y lo destruirán.
Rutherford
no pudo dar una explicación adecuada para sostener se modelo atómico, por lo
que este hecho constituyo una de sus fallas principales.
Por
tal razón, Niels Bohr propuso en 1913 su teoría como una respuesta posible que
explica la estabilidad del átomo. Sugirió que los electrones al moverse por
dentro de una misma orbita no perdían ni ganaban energía, por lo que al girar
continuamente alrededor del núcleo no colapsaría entre si.
Interacciones entre nucleones
Los
nucleones, al mantenerse juntos, permiten la estabilidad el núcleo. Sin
embargo, una pregunta interesante: ? Como se pueden mantener juntos los
protones en el núcleo si sus cargas eléctricas son iguales y deberían causar
una repulsión eléctrica que terminara desintegrando el núcleo atómico? La
respuesta a esta pregunta la dio en 1935 Hiedki Yukawa (1907-1981).
Evidentemente,
debe existir una fuerza que supere esta tendencia de repulsión de los protones:
se denomina Fuerza Nuclear Fuerte y actúa entre partículas subatómicas que
están muy cercanas entre si, como en el caso de los protones y neutrones en el
núcleo. Esta fuerza es superior a la fuerza eléctrica que tiende separar los
protones de uno de otro. La fuerza
nuclear mantiene las interacciones proton-proton, proton-neutron y
neutrón-neutrón, de modo que el núcleo atómico se mantiene estable. Sin
embargo, debido a que a la fuerza nuclear fuerte solo se da entre protones y
neutrones vecinos, la estabilidad del átomo despende de su tamaño.
Los
núcleos de átomos muy grandes tienden a ser menos estables que los pequeños.
Esto se debe a que mientras mas grande se el átomo, mayor será el numero de
protones en el núcleo que se tienen que estabilizar, y en un átomo grande no
todos los nucleones son vecinos. Estos casos, las fuerzas nucleares son
superadas por las eléctricas, por lo que el núcleo se desintegra emitiendo
partículas subatómicas, fenómeno conocida como radiactividad.
El metodo de la lluvia es
el método usado en química para describir la configuración electrónica de los
elementos tomando en cuenta su número atómico. Se usa para ubicar al elemento
en la tabla sacando su grupo y periodo... y es usado para muchas cosas más.
Así
sucesivamente, donde al S le caben dos electrones, al p le caben 6 electrones,
al d le caben 10 electrones y al F le caben 14 electrones un ejemplo para esto
es:
Na
(Z=11)= 1S (2) 2S (2) 2p (6) 3s (1) los números que están en paréntesis son los
números a los q esta elevado la letra, la sumatoria de estos números debe ser
igual al numero atómico del elemento (Z)
La configuración electrónica del átomo de un elemento corresponde a la ubicación de los electrones en los orbitales de los diferentes niveles de energía. Aunque el modelo de Scrödinger es exacto sólo para el átomo de hidrógeno, para otros átomos es aplicable el mismo modelo mediante aproximaciones muy buenas.
La manera de mostrar cómo se distribuyen los electrones en un átomo, es a través de la configuración electrónica. El orden en el que se van llenando los niveles de energía es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p. El esquema de llenado de los orbitales atómicos, lo podemos tener utilizando la regla de la diagonal, para ello debes seguir atentamente la flecha del esquema comenzando en 1s; siguiendo la flecha podrás ir completando los orbitales con los electrones en forma correcta.

Escribiendo configuraciones electrónicas
Para escribir la configuración electrónica de un átomo es necesario:
- Saber el número de electrones que el átomo tiene; basta conocer el número atómico (Z) del átomo en la tabla periódica. Recuerda que el número de electrones en un átomo neutro es igual al número atómico (Z = p+).
- Ubicar los electrones en cada uno de los niveles de energía, comenzando desde el nivel más cercano al núcleo (n = 1).
- Respetar la capacidad máxima de cada subnivel (s = 2e-, p = 6e-, d = 10e- y f = 14e-).
Ejemplo:
Los
orbitales se llenan en orden creciente de energía, con no más de dos
electrones por orbital, según el principio de construcción de Aufbau.
Litio
(Z = 3). Este elemento tiene 3 electrones. Empezaremos llenando el
orbital de menor energía con dos electrones que tendrán distinto spin
(ms). El electrón restante ocupará el orbital 2s, que es el siguiente
con menor energía: 

Por el método de la lluvia se llena en el siguiente orden (1s 2s 2p 3s 3p 4s 3d 4p 5s... es cono si pasaras una flecha diagonal leyendo de derecha a izquierda.
Buenas tardes, he recomendado su enlace de la regla de la lluvia en mi blog http://alkimia-quimika.blogspot.com me pareció muy bueno.
ResponderEliminarGracias anticipadas
esta es la misma informacion que sale en buenas tareas
ResponderEliminarbecerro!!
ResponderEliminar